| 氨 | |
|---|---|
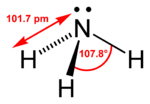
| |

| |
| IUPAC名 Ammonia [1] | |
| 系統名 Azane | |
| 別名 | 氮烷、阿摩尼亞 |
| 識別 | |
| CAS號 | 7664-41-7 |
| PubChem | 222 |
| ChemSpider | 217 |
| SMILES |
|
| InChI |
|
| InChIKey | QGZKDVFQNNGYKY-UHFFFAOYAF |
| Beilstein | 3587154 |
| Gmelin | 79 |
| 3DMet | B00004 |
| UN編號 | 1005 |
| EINECS | 231-635-3 |
| ChEBI | 16134 |
| RTECS | BO0875000 |
| KEGG | D02916 |
| MeSH | Ammonia |
| 性質 | |
| 化學式 | NH3 |
| 摩爾質量 | 17.0306 g·mol⁻¹ |
| 外觀 | 具有非常刺鼻的氣味的無色氣體 |
| 密度 | 0.86 kg/m3 (1.013 bar ,沸點) 0.769 kg/m3 (STP)[2] |
| 熔點 | −77.73 °C(−107.91 °F;195.42 K)[5] |
| 沸點 | −33.34 °C(−28.01 °F;239.81 K)[5] |
| 溶解性(水) | 1:700 (0℃,100kPa) |
| 溶解性 | 可溶於氯仿、乙醚、乙醇和甲醇 |
| pKa | 32.5 (−33℃),[6] 10.5 (DMSO) |
| pKb | 4.75 (與水反應)[5] |
| 黏度 |
|
| 結構 | |
| 分子構型 | 三角錐 |
| 偶極矩 | 1.42 D |
| 熱力學 | |
| ΔfHm |
−46 kJ·mol−1[8] |
| S |
193 J·mol−1·K−1[8] |
| 危險性 | |
GHS危險性符號   [9] [9]
| |
| GHS提示詞 | Danger |
| H-術語 | H290, H301, H311, H314, H330, H334, H336, H360, H362, H373, H400 |
| P-術語 | P202, P221, P233, P261, P263, P271, P273, P280, P305+351+338, P310[9] |
| NFPA 704 | |
| 爆炸極限 | 15–28% |
| PEL | 50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) |
| 致死量或濃度: | |
LD50(中位劑量)
|
0.015 mL/kg (人類口服) |
LC50(中位濃度)
|
40,300 ppm (大鼠, 10 min) 28,595 ppm (大鼠, 20 min) 20,300 ppm (大鼠, 40 min) 11,590 ppm (大鼠, 1 hr) 7338 ppm (大鼠, 1 hr) 4837 ppm (小鼠。 1 hr) 9859 ppm (兔子, 1 hr) 9859 ppm (貓, 1 hr) 2000 ppm (小鼠, 4 hr) 4230 ppm (小鼠, 1 hr)[10] |
LCLo(最低)
|
5000 ppm (哺乳動物, 5 min) 5000 ppm (人類, 5 min)[10] |
| 相關物質 | |
| 其他陰離子 | 一水合氨 (NH3H2O) |
| 其他陽離子 | 銨 (NH4+) |
| 相關氫化物 | 氯化銨 (NH4Cl)、磷化氫、砷化氫、銻化氫、鉍化氫 |
| 相關化學品 | 肼、疊氮酸、鹽酸羥胺、氯胺 |
| 若非註明,所有數據均出自一般條件(25 ℃,100 kPa)下。 | |
氨[11](英語:Ammonia,或稱氨氣、無水氨,曾音譯作𠼞、氬、阿摩尼亞,分子式為NH3)是無色氣體,有強烈刺激氣味(尿味),極易溶於水。常溫常壓下,1單位體積水可溶解700倍體積的氨。[5]氨對地球上的生物相當重要,是所有食物和肥料的重要成分。氨也是很多藥物和商業清潔用品直接或間接的組成部分,具有腐蝕性等危險性質。
由於氨有廣泛的用途,成為世界上產量最多的無機化合物之一,約八成用於製作化肥。2006年,氨的全球產量估計為1.465億噸,主要用於製造商業清潔產品。
製法
固體銨鹽製取
加熱固體銨鹽和鹼的混合物 反應原理:
反應裝置:固體+固體加熱制氣體裝置。包括試管、酒精燈、鐵架台(帶鐵夾)等。
淨化裝置(可省略):用鹼石灰乾燥。
收集裝置: 向下排空氣法,驗滿方法是用濕潤的紅色石蕊試紙置於試管口,試紙變藍色;或將蘸有濃鹽酸的玻璃棒置於試管口,有白煙產生。
尾氣裝置:收集時,一般在管口塞一團棉花球,可減少NH3與空氣的對流速度,收集到純淨的NH3。
注意事項:不能用NH4NO3跟Ca(OH)2反應制氨氣。硝酸銨受撞擊、加熱易爆炸,且產物與溫度有關,可能產生NH3、N2、N2O、NO。
實驗室制NH3不能用NaOH、KOH代替Ca(OH)2。因為NaOH、KOH是強鹼,具有吸濕性(潮解)易結塊,不易與銨鹽混合充分接觸反應。又KOH、NaOH具有強腐蝕性在加熱情況下,對玻璃儀器有腐蝕作用,所以不用NaOH、KOH代替Ca(OH)2制NH3。
用試管收集氨氣要堵棉花。因為NH3分子微粒直徑小,易與空氣發生對流,堵棉花目的是防止NH3與空氣對流,確保收集純淨;減少NH3對空氣的污染。
實驗室制NH3除水蒸氣用鹼石灰,而不採用濃H2SO4和固體CaCl2。因為濃H2SO4與NH3反應生成(NH4)2SO4。NH3與CaCl2反應能生成CaCl2·8NH3(八氨合氯化鈣)。
氮化物製法
可以用氮化物與水反應或者疊氮化物分解。如:
濃氨水製取
反應原理:。這種方法一般用於實驗室快速制氨氣。
裝置:燒瓶,酒精燈,鐵架台,橡膠塞,導管等。
注意事項:加熱濃氨水時也會有水蒸氣,需要用乾燥裝置除雜。同上,這種方法制NH3除水蒸氣用鹼石灰,而不要採用濃H2SO4和固體CaCl2。[12]
濃氨水中存在以下平衡:
NH3+H2O ⇌ NH3·H2O ⇌NH4+ +OH-
加入固態鹼性物質(如CaO,NaOH,鹼石灰等),消耗水且使OH-的數量增加,使平衡往中間移動,同時反應放熱,促使NH3·H2O的分解。
工業合成氨
合成氨指由氫氣、氮氣在高壓、高溫、催化劑作用下直接化合生成的氨,是固氮的一種方法。目前世界上的氨,除少數從焦爐氣中回收的副產品外,絕大部分均由合成法製造。反應必須通過使用催化劑完成。
測試
由於氨是弱鹼性,所以用紅色石蕊紙測試氨,會呈藍色。由於氨氣是氣體,所以要先浸濕試紙。
氨水
氨水(NH3(aq),也常寫成 NH4OH)又稱為阿摩尼亞水,指氨的水溶液,有強烈刺鼻氣味,具弱鹼性。
氨水中,氨氣分子發生微弱水解生成氫氧根離子及銨根離子。「氫氧化銨」事實上並不存在,只是對氨水溶液中的離子的描述,並無法從溶液中分離出來。
氨的在水中的電離可以表示為:
反應平衡常數。
1M氨水的pH值為11.63,大約有0.42%的NH3變為NH+4。
氨水是實驗室中氨的常用來源。它可與含銅(II)離子的溶液作用生成深藍色的配合物,也可用於配置銀氨溶液等分析化學試劑。
用途
- 氨水可被土中的土壤膠體吸附和被作物吸收,無殘留物質,適用於各種土壤和作物。
- 由於氨擁有強烈的刺激性氣味,在醫療方面,會用少量易於揮發的氨作為使人清醒的吸入劑。
- 生產硝酸
- 玻璃清潔劑
- 有八成的氨生產氮肥
- 航空燃料(X-15)
- 氨是最廣泛用的製冷劑之一,可用於空調、冷藏和低溫,能用於各種形式的製冷壓縮機,蒸發溫度可控制在5度至零下65度,代號R717。
反應
絡合反應
NH3分子中氮原子有一對孤對電子,可以作為電子對給予體(路易斯鹼)形成加合物。如氨在氫離子絡合生成銨離子:
NH3亦可與金屬離子如Ag+、Cu2+等發生錯合,生成錯合物:
氧化還原
NH3分子中氮為-3價,在適當條件下可被氧化為N2或更高價氮化合物。
如NH3在純氧中燃燒,生成N2:
在鉑催化下可氧化生成水與一氧化氮,是工業制硝酸的重要反應。
可還原CuO為Cu:
常溫下NH3可與強氧化劑(如氯氣、過氧化氫、高錳酸鉀)直接反應:
酸鹼中和
氨與強酸反應,生成的鹽大多為弱酸性。氨與弱酸(如乙酸)反應,鹽則為中性。
酸鹼中和是放熱反應。
有機反應
氨分子的氮上有一對孤對電子,而且帶部分負電荷,因此氨具有親核性。換言之,氨是個親核試劑,因此可與親電體反應。
例如,氨與鹵代烴發生雙分子親核取代反應生成胺。該反應又稱氨解反應。
液氨
液氨(NH3)指的是液態的氨,為工業上氨氣的主要儲存形式。是一種常用的非水溶劑和製冷劑,也是除了水以外最常用的無機溶劑。不過由於它的揮發性和腐蝕性,液氨在儲存和運輸時發生事故的機率也相當高。
備註
- ↑ NOMENCLATURE OF INORGANIC CHEMISTRY IUPAC Recommendations 2005 (PDF).
- ↑ Gases – Densities. [3 March 2016].
- ↑ Yost, Don M. Ammonia and Liquid Ammonia Solutions. Systematic Inorganic Chemistry. READ BOOKS. 2007: 132. ISBN 978-1-4067-7302-6. 已忽略文本「chapter-」 (幫助)
- ↑ Blum, Alexander. On crystalline character of transparent solid ammonia. Radiation Effects and Defects in Solids. 1975, 24 (4): 277. doi:10.1080/00337577508240819.
- ↑ 5.0 5.1 5.2 5.3 氨;氨气;ammonia. 化工引擎. [2008-05-06].
- ↑ Perrin, D. D., Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution; 2nd Ed., Pergamon Press: Oxford, 1982.
- ↑ Iwasaki, Hiroji; Takahashi, Mitsuo. Studies on the transport properties of fluids at high pressure. The Review of Physical Chemistry of Japan. 1968, 38 (1).
- ↑ 8.0 8.1 Zumdahl, Steven S. Chemical Principles 6th Ed.. Houghton Mifflin Company. 2009: A22. ISBN 978-0-618-94690-7.
- ↑ 9.0 9.1 來源:Sigma-Aldrich Co., Ammonia (20 July 2013查閱).
- ↑ 10.0 10.1 Ammonia. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ (拼音:ān)拼音:ān,注音:ㄢ,音同「安」
- ↑ 实验室如何制取氨气 有什么其它制作方法呢_氨气的预防方法_氨气制法的其它方法_健康资讯_快速问医生. m.120ask.com. [2021-01-07].
