| 硝酸 | |
|---|---|
| |
| |
| |
| IUPAC名 Nitric acid | |
| 别名 | 硝镪水 |
| 识别 | |
| CAS号 | 7697-37-2 |
| PubChem | 944 |
| ChemSpider | 919 |
| SMILES |
|
| InChI |
|
| InChIKey | GRYLNZFGIOXLOG-UHFFFAOYAO |
| Gmelin | 1576 |
| 3DMet | B00068 |
| UN编号 | 2031 |
| EINECS | 231-714-2 |
| ChEBI | 48107 |
| RTECS | QU5775000 |
| KEGG | D02313 |
| MeSH | Nitric+acid |
| 性质 | |
| 化学式 | HNO3 |
| 摩尔质量 | 63.012 g·mol⁻¹ |
| 外观 | 无色清澈液体 |
| 密度 | 1.51 g/cm³ |
| 熔点 | -42 °C(231 K) |
| 沸点 | 83 °C(356 K)(纯酸) (68%aq沸点120.5℃) |
| 溶解性(水) | 完全混溶 |
| 偶极矩 | 2.17±0.02D |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R8-R35 |
| 安全术语 | S:S1/2-S23-S26-S36-S45 |
| NFPA 704 | |
| 闪点 | 不可燃 |
| 相关物质 | |
| 相关化学品 | 亚硝酸 五氧化二氮 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
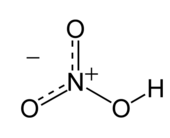
硝酸(分子式:HNO3)是一种强酸,是三大强酸其一,其水溶液俗称硝镪水。纯硝酸为无色液体,沸点83℃,味苦,在-42℃时凝结为无色晶体,与水混溶,有强氧化性和腐蚀性。其不同浓度水溶液性质有别,市售浓硝酸为共沸物,溶质质量分数为69.2%,一大气压下沸点为121.6℃,密度为1.42g·cm−3,约16mol·L−1,溶质重量百分比足够大(市售浓度最高为98%以上)的,称为发烟硝酸,硝酸是一种重要的化工原料。
历史
硝酸和硫酸一样由公元8世纪阿拉伯炼金术士阿布·穆萨·贾比尔·伊本·哈扬(Jabir ibn Hayyan)在干馏绿矾和硝石混合物时发现,也是一种化学肥料。[1]因为硝酸是在硝石中发现的,所以含氧氮酸不叫氮酸,叫硝酸。
自然存在
雷雨时能产生少量的硝酸。打雷时放出的能量让空气中的N2和O2发生反应,产生NO:
- N2 + O2 → 2NO
- 2NO + O2 → 2NO2
- N2 + 2O2 → 2NO2
NO2和水反应产生硝酸和一氧化氮:
- 3NO2 + H2O → 2HNO3 + NO
有些海鞘(Ciona intestinalis)也能分泌硝酸御敌[2]。
结构
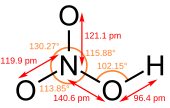
硝酸是平面分子,其中心原子N原子为sp2杂化。由于羟基上的氢原子与另外一个氧原子形成了氢键,分子才呈平面结构,而且N的三根键长都不相同。N原子垂直于分子平面的一个p轨道是满的,它与未连接H的两个氧原子上的p轨道共轭,形成大Π键。分子内氢键也是硝酸沸点较低的原因。
硝酸去掉一个氢原子的结构是硝酸根,一般带一个负电荷(硝酸根离子)。硝酸根具有对称的平面等边三角形结构,4个原子形成大键,多出来的1个电子在离域Π键里。[来源请求]
硝酸去掉一个羟基的结构是硝基-NO2。硝基的正离子叫硝酰正离子。
物理性质
纯硝酸为无色、容易挥发的液体,沸点约为83℃,凝固点约为-42℃,密度为1.51g/ml。可以与水以任意比例互溶。硝酸是二氧化氮溶于水生成的,但由于二氧化氮溶于水并不会完全水解成硝酸,会有少量的二氧化氮分子存在,因此硝酸水溶液呈淡黄色,也会挥发出棕红色的NO2。一般的浓硝酸指的是16mol/L的HNO3水溶液,密度为1.42g/ml。
-
发烟硝酸
-
70%硝酸
化学性质
纯硝酸可以发生自偶电离:2HNO3⇌H2O+NO2++NO3-
硝酸作为氮的最高价(+5)水化物,具有很强的酸性,一般情况下认为硝酸的水溶液是完全电离的。硝酸可以与醇发生酯化反应,如硝酸甘油的制备。(实际上我们会使用浓硫酸,产生大量NO2+),成本较低而且较容易处理,与其他更强的脱水剂,例如P4O10,也可以产生大量的硝酰阳离子,这是硝化反应能进行的本质。
- HNO3 + H2O → H3O+ + NO3- (水中)
- HO-NO2 + 2H2SO4 → NO2+ + 2HSO4- + H3O+ (浓硫酸中)
硝酸的水溶液无论浓稀均具强氧化性及腐蚀性,溶液越浓其氧化性越强。硝酸在光照条件下分解成水、NO2和O2,方程式如下:
- 4HNO3 → 4NO2 + O2 + 2H2O
因此硝酸一定要盛放在棕色瓶中,并置于阴凉处保存。硝酸能溶解许多种金属(例如银),生成盐、水、氮氧化物。随着溶液浓度的减小,其还原产物逐渐由高价向低价过渡,从最浓到最稀可生成NO2、NO、N2O、N2、NH4NO3。还原产物一般是混合物,金属与浓硝酸反应多生成NO2,与稀硝酸反应下生成如NO等较低价化合物。
铁、铝、铬等金属遇冷的浓硝酸可以发生钝化现象,只在表面形成一层致密的氧化膜,不会完全反应掉。
浓硝酸和浓盐酸的物质的量按1:3混合,即为王水,能溶解金、铂等稳定金属。
硝酸盐大多易遇热分解,生成氧气、氮氧化物、金属氧化物(也可能生成亚硝酸盐等)。
硝酸铵中的硝酸根与铵根,平均能量大于有其平均价数之一氧化二氮,在固态时发生均化反应(因为动力学原因,在溶液内不发生)(NH4NO3)即加热或撞击分解生成一氧化二氮和水,一般使用现代合成炸药引爆,威力与TNT相去不远,但成本极低。因此被用于国防工业及工程上而被誉为国防工业之母(主要制造硝基含能化合物(现代合成炸药)。硝酸钾就是黑火药的成分之一)。
HNO3+NaOH→NaNO3+H2O
制备
4NH3(g)+5O2(g)→4NO(g)+6H2O(g)(铂铑催化)(ΔH=−905.2kJ/mol)
2NO(g)+O2(g)→2NO2(g) (ΔH=−114kJ/mol)
3NO2(g)+H2O(l)→2HNO3(aq)+NO(g) (ΔH=−117kJ/mol)
总式:NH3(g)+2O2(g)→H2O(l)+HNO3(aq)(铂铑催化)
反复把生成的气体通入水中,即可得到较纯的硝酸。其原料二氧化氮是由氨氧化而得,因此硝酸工业与制氨工业密不可分。
纯硝酸制备
NaNO3+H2SO4→NaHSO4+HNO3
其二步反应是硫酸氢盐与硝酸盐反应,值得注意的是,因为反应温度更高,所以硝酸会分解,影响产率。
工业用途
硝酸是在工业上和实验室中都很常用的一种酸。
作为硝酸盐和硝酸酯的必需原料,硝酸被用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取硝酸酯类或含硝基的炸药,如三硝基甲苯(TNT)、硝化甘油。
由于它同时具有氧化性和酸性,硝酸也被用来精炼金属:即先把不纯的金属氧化成硝酸盐,排除杂质后再还原。
人体影响
硝酸不论浓稀溶液都有氧化性和腐蚀性,因此对人很危险,仅溅到皮肤上也会引起严重烧伤。皮肤接触硝酸后会慢慢变黄,最后变黄的表皮会起皮脱落(硝酸和蛋白质接触后,会导致黄蛋白反应而变性)。此外,浓硝酸需以深色玻璃瓶盛装,避免受到光照反应释出有毒的NO2。
与金属的反应
- 2HCl(aq) + Zn(s) → ZnCl2(aq) + H2(g)
而硝酸与金属反应,不会生成氢气。这是因为硝酸根(NO3-)的氧化性比氢离子(H+)强。
浓硝酸(约16mol/L)与金属反应,主要生成红棕色的二氧化氮气体:
- Zn(s) + 4HNO3(aq) → Zn(NO3)2(aq) + 2NO2(g) + 2H2O(l)
稀硝酸(约6mol/L)与金属反应,主要生成一氧化氮气体:
- 3Zn(s) + 8HNO3(aq) → 3Zn(NO3)2(aq) + 2NO(g) + 4H2O(l)
更稀的硝酸(约2mol/L以下)与金属反应,产物从一氧化二氮到氮气到铵根离子不等。
普遍认为,硝酸与金属反应时,各还原产物(NO2、NO、N2O、N2、NH3)都可以生成。 但由于硝酸、水、氮氧化物、亚硝酸、连二次硝酸等物质间的多个平衡,不同浓度硝酸的还原产物有很大差异。
极稀硝酸和活泼金属生成氢气的说法,没有得到证实。
参考
注释
- ↑ Nitric Acid. [2020-09-15].
- ↑ P. W. Atkins, Molecules, 1987, ISBN 0-7167-5019-8




