| 硝酸 | |
|---|---|
| |
| |
| |
| IUPAC名 Nitric acid | |
| 別名 | 硝鏹水 |
| 識別 | |
| CAS號 | 7697-37-2 |
| PubChem | 944 |
| ChemSpider | 919 |
| SMILES |
|
| InChI |
|
| InChIKey | GRYLNZFGIOXLOG-UHFFFAOYAO |
| Gmelin | 1576 |
| 3DMet | B00068 |
| UN編號 | 2031 |
| EINECS | 231-714-2 |
| ChEBI | 48107 |
| RTECS | QU5775000 |
| KEGG | D02313 |
| MeSH | Nitric+acid |
| 性質 | |
| 化學式 | HNO3 |
| 摩爾質量 | 63.012 g·mol⁻¹ |
| 外觀 | 無色清澈液體 |
| 密度 | 1.51 g/cm³ |
| 熔點 | -42 °C(231 K) |
| 沸點 | 83 °C(356 K)(純酸) (68%aq沸點120.5℃) |
| 溶解性(水) | 完全混溶 |
| 偶極矩 | 2.17±0.02D |
| 危險性 | |
| 歐盟危險性符號 | |
| 警示術語 | R:R8-R35 |
| 安全術語 | S:S1/2-S23-S26-S36-S45 |
| NFPA 704 | |
| 閃點 | 不可燃 |
| 相關物質 | |
| 相關化學品 | 亞硝酸 五氧化二氮 |
| 若非註明,所有數據均出自一般條件(25 ℃,100 kPa)下。 | |
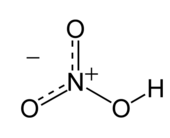
硝酸(分子式:HNO3)是一種強酸,是三大強酸其一,其水溶液俗稱硝鏹水。純硝酸為無色液體,沸點83℃,味苦,在-42℃時凝結為無色晶體,與水混溶,有強氧化性和腐蝕性。其不同濃度水溶液性質有別,市售濃硝酸為共沸物,溶質質量分數為69.2%,一大氣壓下沸點為121.6℃,密度為1.42g·cm−3,約16mol·L−1,溶質重量百分比足夠大(市售濃度最高為98%以上)的,稱為發煙硝酸,硝酸是一種重要的化工原料。
歷史
硝酸和硫酸一樣由公元8世紀阿拉伯鍊金術士阿布·穆薩·賈比爾·伊本·哈揚(Jabir ibn Hayyan)在乾餾綠礬和硝石混合物時發現,也是一種化學肥料。[1]因為硝酸是在硝石中發現的,所以含氧氮酸不叫氮酸,叫硝酸。
自然存在
雷雨時能產生少量的硝酸。打雷時放出的能量讓空氣中的N2和O2發生反應,產生NO:
- N2 + O2 → 2NO
- 2NO + O2 → 2NO2
- N2 + 2O2 → 2NO2
NO2和水反應產生硝酸和一氧化氮:
- 3NO2 + H2O → 2HNO3 + NO
有些海鞘(Ciona intestinalis)也能分泌硝酸禦敵[2]。
結構
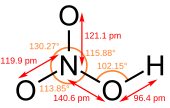
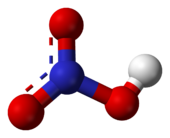
硝酸是平面分子,其中心原子N原子為sp2雜化。由於羥基上的氫原子與另外一個氧原子形成了氫鍵,分子才呈平面結構,而且N的三根鍵長都不相同。N原子垂直於分子平面的一個p軌道是滿的,它與未連接H的兩個氧原子上的p軌道共軛,形成大Π鍵。分子內氫鍵也是硝酸沸點較低的原因。
硝酸去掉一個氫原子的結構是硝酸根,一般帶一個負電荷(硝酸根離子)。硝酸根具有對稱的平面等邊三角形結構,4個原子形成大鍵,多出來的1個電子在離域Π鍵裡。[來源請求]
硝酸去掉一個羥基的結構是硝基-NO2。硝基的正離子叫硝酰正離子。
物理性質
純硝酸為無色、容易揮發的液體,沸點約為83℃,凝固點約為-42℃,密度為1.51g/ml。可以與水以任意比例互溶。硝酸是二氧化氮溶於水生成的,但由於二氧化氮溶於水並不會完全水解成硝酸,會有少量的二氧化氮分子存在,因此硝酸水溶液呈淡黃色,也會揮發出棕紅色的NO2。一般的濃硝酸指的是16mol/L的HNO3水溶液,密度為1.42g/ml。
-
發煙硝酸
-
70%硝酸
化學性質
純硝酸可以發生自偶電離:2HNO3⇌H2O+NO2++NO3-
硝酸作為氮的最高價(+5)水化物,具有很強的酸性,一般情況下認為硝酸的水溶液是完全電離的。硝酸可以與醇發生酯化反應,如硝酸甘油的製備。(實際上我們會使用濃硫酸,產生大量NO2+),成本較低而且較容易處理,與其他更強的脫水劑,例如P4O10,也可以產生大量的硝醯陽離子,這是硝化反應能進行的本質。
- HNO3 + H2O → H3O+ + NO3- (水中)
- HO-NO2 + 2H2SO4 → NO2+ + 2HSO4- + H3O+ (濃硫酸中)
硝酸的水溶液無論濃稀均具強氧化性及腐蝕性,溶液越濃其氧化性越強。硝酸在光照條件下分解成水、NO2和O2,方程式如下:
- 4HNO3 → 4NO2 + O2 + 2H2O
因此硝酸一定要盛放在棕色瓶中,並置於陰涼處保存。硝酸能溶解許多種金屬(例如銀),生成鹽、水、氮氧化物。隨着溶液濃度的減小,其還原產物逐漸由高價向低價過渡,從最濃到最稀可生成NO2、NO、N2O、N2、NH4NO3。還原產物一般是混合物,金屬與濃硝酸反應多生成NO2,與稀硝酸反應下生成如NO等較低價化合物。
鐵、鋁、鉻等金屬遇冷的濃硝酸可以發生鈍化現象,只在表面形成一層緻密的氧化膜,不會完全反應掉。
濃硝酸和濃鹽酸的物質的量按1:3混合,即為王水,能溶解金、鉑等穩定金屬。
硝酸鹽大多易遇熱分解,生成氧氣、氮氧化物、金屬氧化物(也可能生成亞硝酸鹽等)。
硝酸銨中的硝酸根與銨根,平均能量大於有其平均價數之一氧化二氮,在固態時發生均化反應(因為動力學原因,在溶液內不發生)(NH4NO3)即加熱或撞擊分解生成一氧化二氮和水,一般使用現代合成炸藥引爆,威力與TNT相去不遠,但成本極低。因此被用於國防工業及工程上而被譽為國防工業之母(主要製造硝基含能化合物(現代合成炸藥)。硝酸鉀就是黑火藥的成分之一)。
HNO3+NaOH→NaNO3+H2O
製備
4NH3(g)+5O2(g)→4NO(g)+6H2O(g)(鉑銠催化)(ΔH=−905.2kJ/mol)
2NO(g)+O2(g)→2NO2(g) (ΔH=−114kJ/mol)
3NO2(g)+H2O(l)→2HNO3(aq)+NO(g) (ΔH=−117kJ/mol)
總式:NH3(g)+2O2(g)→H2O(l)+HNO3(aq)(鉑銠催化)
反覆把生成的氣體通入水中,即可得到較純的硝酸。其原料二氧化氮是由氨氧化而得,因此硝酸工業與製氨工業密不可分。
純硝酸製備
NaNO3+H2SO4→NaHSO4+HNO3
其二步反應是硫酸氫鹽與硝酸鹽反應,值得注意的是,因為反應溫度更高,所以硝酸會分解,影響產率。
工業用途
硝酸是在工業上和實驗室中都很常用的一種酸。
作為硝酸鹽和硝酸酯的必需原料,硝酸被用來製取一系列硝酸鹽類氮肥,如硝酸銨、硝酸鉀等;也用來製取硝酸酯類或含硝基的炸藥,如三硝基甲苯(TNT)、硝化甘油。
由於它同時具有氧化性和酸性,硝酸也被用來精煉金屬:即先把不純的金屬氧化成硝酸鹽,排除雜質後再還原。
人體影響
硝酸不論濃稀溶液都有氧化性和腐蝕性,因此對人很危險,僅濺到皮膚上也會引起嚴重燒傷。皮膚接觸硝酸後會慢慢變黃,最後變黃的表皮會起皮脫落(硝酸和蛋白質接觸後,會導致黃蛋白反應而變性)。此外,濃硝酸需以深色玻璃瓶盛裝,避免受到光照反應釋出有毒的NO2。
與金屬的反應
- 2HCl(aq) + Zn(s) → ZnCl2(aq) + H2(g)
而硝酸與金屬反應,不會生成氫氣。這是因為硝酸根(NO3-)的氧化性比氫離子(H+)強。
濃硝酸(約16mol/L)與金屬反應,主要生成紅棕色的二氧化氮氣體:
- Zn(s) + 4HNO3(aq) → Zn(NO3)2(aq) + 2NO2(g) + 2H2O(l)
稀硝酸(約6mol/L)與金屬反應,主要生成一氧化氮氣體:
- 3Zn(s) + 8HNO3(aq) → 3Zn(NO3)2(aq) + 2NO(g) + 4H2O(l)
更稀的硝酸(約2mol/L以下)與金屬反應,產物從一氧化二氮到氮氣到銨根離子不等。
普遍認為,硝酸與金屬反應時,各還原產物(NO2、NO、N2O、N2、NH3)都可以生成。 但由於硝酸、水、氮氧化物、亞硝酸、連二次硝酸等物質間的多個平衡,不同濃度硝酸的還原產物有很大差異。
極稀硝酸和活潑金屬生成氫氣的說法,沒有得到證實。
參考
注釋
- ↑ Nitric Acid. [2020-09-15].
- ↑ P. W. Atkins, Molecules, 1987, ISBN 0-7167-5019-8




