錒(拼音:ā,注音:ㄚ,粤拼:aa3;英语:Actinium),是一种化学元素,其化学符号为Ac,原子序数为89,位居錒系元素之首。在元素周期表中,錒系元素始于錒,止于鐒,一共有15种元素。錒是一种柔軟的银白色金属,具强放射性。在空气中,錒会迅速与氧气和水气反应,在表面形成具保护性的白色氧化层。和大部份鑭系元素及錒系元素一样,錒的氧化态一般是+3。
錒在1899年被发现,是首个得到分离的非原始核素(non-primordial radioactive element)。虽然釙、鐳和氡比錒更早被发现,但是科学家到1902年才分离出这些元素。
錒具有高度的放射性,最稳定的同位素是227Ac,会进行β衰变,半衰期为21.772年。由于缺乏长寿命的同位素,在自然界中只有痕量的錒出现在鈾矿石当中,以227Ac为主。每一吨鈾矿石约含0.2毫克的錒元素。由于錒和鑭的化学和物理特性过于接近,因此要从矿石中分离出錒元素并不现实。科学家则是在核反应炉中以中子照射鐳-226来生产錒的。
錒因为稀少、昂贵,且具强放射性,所以沒有大的工业用途。目前錒被用作中子源,以及在放射线疗法中作为辐射源。
历史
法国化学家安德烈-路易·德贝尔恩(André-Louis Debierne)在1899年宣布发现新元素。在玛莉·居礼和皮埃尔·居礼从瀝青鈾矿中分离出鐳之后,德贝尔恩接著从殘留物中再分离出这一新元素。他认为该元素与鈦和釷相似,并将其命名为“actinium”。[2][3]德国化学家弗里德里希·奥斯卡·吉塞尔(Friedrich Oskar Giesel)则在1902年独立发现了錒元素。[4]他认为錒与鑭相似,并在1904年将其命名为“emanium”。[5]科学家在比较德贝尔恩所得出的半衰期数据后,[6]決定依最早发现者的意愿把该元素正式定名为“actinium”。[7][8]
錒的原文名称“actinium”源自古希腊语中的“ακτίς”、“ακτίνος”(“aktis”、“aktinos”),意为光线。[9]其化学符号为Ac,但Ac也同时是其他化学品的缩写,如乙酰基、乙酸鹽[10]和乙醛,但錒与这些并无关系。[11]
属性
錒是一种柔軟的银白色[12][13]放射性金属。其剪切模量估计与鉛相近。[14]錒的放射性很强,它放射出的高能粒子足以把四周的空气电离,因而发出暗蓝色光。[15]錒的化学属性与包括鑭在内的鑭系元素相近,因此要将錒从鈾矿石中分离出来十分困难。分离过程一般使用溶剂萃取法和离子层析法。[16]
錒是首个錒系元素。这些元素彼此间的特性比鑭系元素更多元化,因此直到1945年,格伦·西奥多·西博格才提出为元素周期表加入錒系元素。这是自从德米特里·门捷列夫创造元素周期表以来对周期表最大的变动之一。[17]
錒在空气中会与氧气、水气迅速反应,在表面产生白色的保护性氧化层。[12]与大部份鑭系和錒系元素一样,錒的氧化态通常是+3;Ac3+离子在溶液中无色。[18]錒的电子排布是6d17s2,所以当失去3个电子后,就会形成稳定的闭壳层,与惰性气体氡一样。[13]錒的+2态只出现在二氫化錒(AcH2)中。[19]
化合物
已知的錒化合物非常少,其中有三氟化錒(AcF3)、三氯化錒(AcCl3)、三溴化錒(AcBr3)、氟氧化錒(AcOF)、氯氧化錒(AcOCl)、溴氧化錒(AcOBr)、三硫化二錒(Ac2S3)、氧化錒(Ac2O3)和磷酸錒(AcPO4)等。除AcPO4以外,这些化合物都具有+3氧化态,且都有相对应的鑭化合物。[18][20]对应的鑭和錒化合物在晶格常数上的差异不超过百分之十。[21]
| 化学式 | 颜色 | 对称 | 空间群 | 空间群数 | 皮尔逊符号 | a(pm) | b(pm) | c(pm) | Z | 密度( g/cm3) |
|---|---|---|---|---|---|---|---|---|---|---|
| Ac | 银白色 | fcc[19] | Fm3m | 225 | cF4 | 531.1 | 531.1 | 531.1 | 4 | 10.07 |
| AcH2 | 立方晶系[19] | Fm3m | 225 | cF12 | 567 | 567 | 567 | 4 | 8.35 | |
| Ac2O3 | 白色[12] | 三方晶系[22] | P3m1 | 164 | hP5 | 408 | 408 | 630 | 1 | 9.18 |
| Ac2S3 | 立方晶系[23] | I43d | 220 | cI28 | 778.56 | 778.56 | 778.56 | 4 | 6.71 | |
| AcF3 | 白色[24]:71 | 六方晶系[21][22] | P3c1 | 165 | hP24 | 741 | 741 | 755 | 6 | 7.88 |
| AcCl3 | 六方晶系[21][25] | P63/m | 165 | hP8 | 764 | 764 | 456 | 2 | 4.8 | |
| AcBr3 | 白色[21] | 六方晶系[25] | P63/m | 165 | hP8 | 764 | 764 | 456 | 2 | 5.85 |
| AcOF | 白色[24]:87-88 | 立方晶系[21] | Fm3m | 593.1 | 8.28 | |||||
| AcOCl | 四方晶系[21] | 424 | 424 | 707 | 7.23 | |||||
| AcOBr | 四方晶系[21] | 427 | 427 | 740 | 7.89 | |||||
| AcPO4·0.5H2O | 六方晶系[21] | 721 | 721 | 664 | 5.48 |
上表中的a、b和c为晶格常数,Z为每晶胞所含的化学式单元数。密度并非实验数据,而是从晶体参数中计算得出的。
氧化物
在真空中把氫氧化錒加热至500 °C或把草酸錒加热至1100 °C,可制成氧化錒(Ac2O3)。氧化錒的晶体结构与大部份三价稀土金属的氧化物同型。[21]
鹵化物
三氟化錒的合成反应可以在液态或固态下进行。前者在室温下进行,需将氫氟酸加入含有錒离子的溶液中。后者需对錒金属施以氟化氫气体,反应要在700 °C下进行,并必须使用全鉑制器材。在900至1000 °C下,三氟化錒会和氫氧化銨反应形成氟氧化錒(AcOF)。虽然三氟化鑭在空气中以800 °C燃燒一小时后就可以产生氟氧化鑭,但是类似的方法无法产生氟氧化錒,而是会把三氟化錒熔解。[21][24]:87–88
- AcF3 + 2 NH3 + H2O → AcOF + 2 NH4F
氫氧化錒或草酸錒与四氯化碳在960 °C以上温度反应会产生三氯化錒。同样,三氯化錒与氫氧化銨在1000 °C反应会形成氯氧化錒。但与氟氧化錒不同的是,三氯化錒在氫氯酸溶液中用氨点燃就可以产生氯氧化錒。[21]
溴化鋁与氧化錒反应后,会形成三溴化錒:
- Ac2O3 + 2 AlBr3 → 2 AcBr3 + Al2O3
在500 °C加入氫氧化銨,可以产生溴氧化錒(AcOBr)。[21]
其他化合物
三氯化錒在300 °C下经鉀还原后,可形成氫化錒,其结构可从氫化鑭(LaH2)的结构推测而得。该反应中氫的来源不明。[24]:43
在含錒的氫氯酸溶液中加入磷酸二氫钠(NaH2PO4),会产生白色的半水合磷酸錒(AcPO4·0.5H2O)。草酸錒和硫化氫气体在1400 °C受热几分钟,会产生黑色的硫化錒(Ac2S3)。[21]
同位素
錒一共有36种已知同位素,全部都具有放射性。这些同位素的原子量介乎206 u(206Ac)和236 u(236Ac)。[26]其中最稳定的有:227Ac(半衰期为21.772年)、225Ac(10.0天)和226Ac(29.37小时)。其餘的同位素的半衰期都小于10小时,大部份甚至小于1分钟。寿命最短的錒同位素是217Ac,其半衰期只有69纳秒,会进行α衰变和中子捕获。錒拥有两个亚稳态(同核异构体)。[26]
自然界中的錒元素主要由227Ac组成,此外还有极微量的225Ac和228Ac。纯化后的227Ac在185天后与衰变产物达成平衡。它主要进行β衰变(98.8%),以及少量的α衰变(1.2%)。[18]这些衰变的产物都属于錒衰变系。227Ac发射的β粒子能量较低(46 keV),α辐射的强度较低,可用样本也一般很少,所以很难直接探测到227Ac。因此科学家一般以探测其衰变产物的方法来推算227Ac的量。[18]
| 同位素 | 合成反应 | 衰变形式 | 半衰期 |
|---|---|---|---|
| 221Ac | 232Th(d,9n)225Pa(α)→221Ac | α | 52毫秒 |
| 222Ac | 232Th(d,8n)226Pa(α)→222Ac | α | 5.0秒 |
| 223Ac | 232Th(d,7n)227Pa(α)→223Ac | α | 2.1分钟 |
| 224Ac | 232Th(d,6n)228Pa(α)→224Ac | α | 2.78小时 |
| 225Ac | 232Th(n,γ)233Th(β−)→233Pa(β−)→233U(α)→229Th(α)→225Ra(β−)225Ac | α | 10天 |
| 226Ac | 226Ra(d,2n)226Ac | α、β−、电子捕获 | 29.37小时 |
| 227Ac | 235U(α)→231Th(β−)→231Pa(α)→227Ac | α、β− | 21.77年 |
| 228Ac | 232Th(α)→228Ra(β−)→228Ac | β− | 6.15小时 |
| 229Ac | 228Ra(n,γ)229Ra(β−)→229Ac | β− | 62.7分钟 |
| 230Ac | 232Th(d,α)230Ac | β− | 122秒 |
| 231Ac | 232Th(γ,p)231Ac | β− | 7.5分钟 |
| 232Ac | 232Th(n,p)232Ac | β− | 119秒 |
存量及合成

錒元素在地球上十分稀少,只有痕量的227Ac同位素出现在鈾矿石中:每吨鈾矿石只含有大约0.2毫克的錒。[27][28]227Ac是錒衰变系中的其中一个短暫存在的同位素。该衰变链始于235U(或239Pu),止于稳定同位素207Pb。225Ac则是錼衰变系中短暫存在的同位素。该衰变链始于237Np(或233U),止于近似稳定的209Bi和稳定的205Tl。[29]惟自然界中的錼衰变系早已衰变殆尽,现时地壳中的237Np主要由238U发生核散裂而痕量生成。[30]
含有錒的矿石中也同时含有鑭及其他鑭系元素。然而这些元素的化学、物理特性与錒非常接近,再加上錒含量更为稀少,因此从矿石中分离出錒元素的做法并不具实际性,科学家也从未完全分离出錒。[21]錒元素则通常是在核反应炉中用中子照射226Ra产生的,每次产量以毫克计。[28][31]
该反应的錒产量约为鐳重量的2%。227Ac可再捕获中子,形成少量的228Ac。合成过后,錒需从鐳以及其他的衰变产物中分离出来,这些产物包括釷、釙、鉛和鉍。第一种分离法使用噻吩甲酰三氟丙酮和苯的混合溶液。调整该溶液的pH值,可从含衰变产物的溶液中萃取出特定的元素(錒需要pH 6.0左右)。[27]另一种分离法是在硝酸中以适当的树脂进行负离子交换法,先把鐳和錒与釷分离开来(分离系数为1百万),再用正离子交换树脂和硝酸洗脫液把錒从鐳中提取出来(系数为100)。[32]
德国和澳大利亚的科学家在2000年首次人工合成225Ac。德国超鈾元素研究所所使用的是回旋加速器,而澳大利亚的研究人员则使用位于悉尼圣乔治医院的直线加速器。[33]其合成方法为,对鐳-226目标体进行20至30 MeV能量氘离子撞击。这一反应同时会产生半衰期为29小时的226Ac同位素,但由于225Ac的半衰期有10天,所以前者不会对后者造成不纯。225Ac是一种稀有的同位素,在放射线疗法中有潜在的用途。[34]
在1100至1300 °C间以鋰气体对氟化錒进行还原反应,可以产生錒金属。太高的温度会使产物气化,而太低温则会导致反应不能完全进行。鋰的氟化物揮发性比其他鹼金属的高,因此最适合用于这一反应中。[9][12]
应用
由于存量稀少,价格昂贵,所以錒目前并无重要的工业用途。[9]
227Ac放射性很强,因此有潜力用于放射性同位素热电机中,应用范围包括航天器。227Ac的氧化物和鈹压制后可以作为高效能中子源,其活度高于一般的鋂﹣鈹和鐳﹣鈹中子源。[35]这些应用利用的其实是227Ac的衰变产物。进行β衰变后所产生的同位素会释放α粒子,而鈹则用于捕获这些α粒子,并放出中子。鈹的9Be(α,n)12C核反应截面较高,因此能高效地将α粒子转换为中子。该反应的公式如下:[36]
227AcBe可用于中子水份仪中,以测量土壤中的水份以及在建造公路时进行濕度、密度的质量检验。[37][38]这类探测仪在测井、中子照相、断层摄影术及其他放射性化学范疇中都有应用的空间。[39]
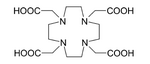
225Ac在医学中用于制造213Bi,[32]或直接作放射线疗法的辐射源。225Ac的半衰期为10天,比213Bi的46小时更适合作放射线治疗。225Ac及其衰变产物所释放的α粒子可以杀死身体内的癌細胞。最大的困难在于,简单的錒配合物经静脉注射进入体内后,会积累在骨骼和肝臟中,并停留数十年。持续的辐射在杀死癌細胞后,会引发新的突变。要避免这种问题,可将225Ac与螯合剂结合,例如檸檬酸、乙二胺四乙酸(EDTA)和二乙烯三胺五乙酸(DTPA)。这可降低錒在骨骼中的积累,但从身体排泄的量仍然不高。改用HEHA[40]或耦合至曲妥珠单抗的DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸)等螯合剂可以增加錒的排泄量。曲妥珠单抗是一种单株抗体,能够干扰HER2/neu受体。科学家把錒与DOTA结合后注射到老鼠体内,发现疗法有效对抗白血病、淋巴瘤、乳癌、卵巢癌、神经母細胞瘤和前列腺癌。[41][42][43]
227Ac的半衰期为21.77年,可用来研究海水的緩慢垂直混合作用。这种水流的速度大约为每年50米,因此直接测量是无法得到足够的精度的。科学家通过探测各同位素在不同深度的相对比例变化,可以推算出混合作用的发生速率。具体的物理原理如下。海水含有均衡分布的235U。其衰变产物231Pa会慢慢沉澱到海底,所以其濃度会随深度增加,并在一定的深度以下维持恒等。231Pa再衰变成227Ac。混合作用会把海底的227Ac提升上来,因此227Ac的濃度随深度一直增加至海底。科学家分析231Pa和227Ac的濃度﹣深度关系,可以间接研究海水的混合作用。[44][45]
安全
227Ac的放射性极强,因此有关的实验都必须在专业实验室的手套箱中进行。当三氯化錒经静脉注射进入老鼠体内后,约33%的錒元素积累在骨骼中,50%进入肝臟。其毒性稍低于鋂和鈽。[46]
参考资料
- ↑ Wall, Greg. C&EN: It's Elemental: The Periodic Table - Actinium. C&EN: It's Elemental: The Periodic Table. Chemical and Engineering News. 2003-09-08 [2013-12-16].
- ↑ Debierne, André-Louis. Sur un nouvelle matière radio-active. Comptes rendus. 1899, 129: 593–595 [2013-12-16].
- ↑ Debierne, André-Louis. Sur un nouvelle matière radio-actif – l'actinium. Comptes rendus. 1900–1901, 130: 906–908 [2013-12-16].
- ↑ Giesel, Friedrich Oskar. Ueber Radium und radioactive Stoffe. Berichte der Deutschen Chemische Geselschaft. 1902, 35 (3): 3608–3611. doi:10.1002/cber.190203503187.
- ↑ Giesel, Friedrich Oskar. Ueber den Emanationskörper (Emanium). Berichte der Deutschen Chemische Geselschaft. 1904, 37 (2): 1696–1699. doi:10.1002/cber.19040370280.
- ↑ Debierne, André-Louis. Sur l'actinium. Comptes rendus. 1904, 139: 538–540.
- ↑ Giesel, Friedrich Oskar. Ueber Emanium. Berichte der Deutschen Chemische Geselschaft. 1904, 37 (2): 1696–1699. doi:10.1002/cber.19040370280.
- ↑ Giesel, Friedrich Oskar. Ueber Emanium. Berichte der Deutschen Chemische Geselschaft. 1905, 38 (1): 775–778. doi:10.1002/cber.190503801130.
- ↑ 9.0 9.1 9.2 Hammond, C. R. The Elements in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ↑ Gilley, Cynthia Brooke; University of California, San Diego. Chemistry. New convertible isocyanides for the Ugi reaction; application to the stereoselective synthesis of omuralide. ProQuest. 2008: 11. ISBN 978-0-549-79554-4.
- ↑ Reimers, Jeffrey R. Computational Methods for Large Systems: Electronic Structure Approaches for Biotechnology and Nanotechnology. John Wiley and Sons. 2011-07-20: 575. ISBN 978-0-470-48788-4.
- ↑ 12.0 12.1 12.2 12.3 Stites, Joseph G.; Salutsky, Murrell L.; Stone, Bob D. Preparation of Actinium Metal. J. Am. Chem. Soc. 1955, 77 (1): 237–240. doi:10.1021/ja01606a085.
- ↑ 13.0 13.1 Actinium, in Encyclopædia Britannica, 15th edition, 1995, p. 70
- ↑ Frederick Seitz, David Turnbull Solid state physics: advances in research and applications , Academic Press, 1964 ISBN 978-0-12-607716-2 pp. 289–291
- ↑ Richard A. Muller. Physics and Technology for Future Presidents: An Introduction to the Essential Physics Every World Leader Needs to Know. Princeton University Press. 2010-04-12: 136. ISBN 978-0-691-13504-5.
- ↑ Katz, J. J.; Manning, W M. Chemistry of the Actinide Elements Annual Review of Nuclear Science. Annual Review of Nuclear Science. 1952, 1: 245–262. Bibcode:1952ARNPS...1..245K. doi:10.1146/annurev.ns.01.120152.001333.
- ↑ Seaborg, Glenn T. The Transuranium Elements. Science. 1946, 104 (2704): 379–386. Bibcode:1946Sci...104..379S. JSTOR 1675046. PMID 17842184. doi:10.1126/science.104.2704.379.
- ↑ 18.0 18.1 18.2 18.3 Actinium. Great Soviet Encyclopedia. [2013-12-16].
- ↑ 19.0 19.1 19.2 Farr, J; Giorgi, A.L.; Bowman, M.G.; Money, R.K. The crystal structure of actinium metal and actinium hydride. Journal of Inorganic and Nuclear Chemistry. 1961, 18: 42. doi:10.1016/0022-1902(61)80369-2.
- ↑ Sherman, Fried; Hagemann, French; Zachariasen, W. H. The Preparation and Identification of Some Pure Actinium Compounds. Journal of the American Chemical Society. 1950, 72 (2): 771–775. doi:10.1021/ja01158a034.
- ↑ 21.00 21.01 21.02 21.03 21.04 21.05 21.06 21.07 21.08 21.09 21.10 21.11 21.12 21.13 Fried, Sherman; Hagemann, French; Zachariasen, W. H. The Preparation and Identification of Some Pure Actinium Compounds. Journal of the American Chemical Society. 1950, 72 (2): 771. doi:10.1021/ja01158a034.
- ↑ 22.0 22.1 Zachariasen, W. H. Crystal chemical studies of the 5f-series of elements. XII. New compounds representing known structure types. Acta Crystallographica. 1949, 2 (6): 388. doi:10.1107/S0365110X49001016.
- ↑ Zachariasen, W. H. Crystal chemical studies of the 5f-series of elements. VI. The Ce2S3-Ce3S4 type of structure. Acta Crystallographica. 1949, 2: 57. doi:10.1107/S0365110X49000126.
- ↑ 24.0 24.1 24.2 24.3 Meyer, Gerd; Morss, Lester R. Synthesis of lanthanide and actinide compounds. Springer. 1991. ISBN 0-7923-1018-7.
- ↑ 25.0 25.1 Zachariasen, W. H. Crystal chemical studies of the 5f-series of elements. I. New structure types. Acta Crystallographica. 1948, 1 (5): 265. doi:10.1107/S0365110X48000703.
- ↑ 26.0 26.1 Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A.H. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ↑ 27.0 27.1 Hagemann, French. The Isolation of Actinium. Journal of the American Chemical Society. 1950, 72 (2): 768. doi:10.1021/ja01158a033.
- ↑ 28.0 28.1 Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016: 946. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ↑ C.M. Lederer; J.M. Hollander; I. Perlman. Table of Isotopes 6th. New York: John Wiley & Sons. 1968.
- ↑ Lehto, Jukka; Hou, Xiaolin. Chemistry and Analysis of Radionuclides: Laboratory Techniques and Methodology. Wiley-VCH. 2011: 2–3. ISBN 978-3-527-32658-7.
- ↑ Emeleus, H. J. Advances in inorganic chemistry and radiochemistry. Academic Press. 1987-07: 16. ISBN 978-0-12-023631-2.
- ↑ 32.0 32.1 Bolla, Rose A.; Malkemus, D; Mirzadeh, S. Production of actinium-225 for alpha particle mediated radioimmunotherapy. Applied Radiation and Isotopes. 2005, 62 (5): 667–679. PMID 15763472. doi:10.1016/j.apradiso.2004.12.003.
- ↑ Melville, G; Allen, Bj. Cyclotron and linac production of Ac-225. Applied radiation and isotopes. 2009, 67 (4): 549–55. PMID 19135381. doi:10.1016/j.apradiso.2008.11.012.
- ↑ Russell, Pamela J.; Jackson, Paul and Kingsley, Elizabeth Anne Prostate cancer methods and protocols , Humana Press, 2003, ISBN 978-0-89603-978-0, p. 336
- ↑ Russell, Alan M. and Lee, Kok Loong Structure-property relations in nonferrous metals , Wiley, 2005, ISBN 978-0-471-64952-6, pp. 470–471
- ↑ Hausner, Henry H. Nuclear Properties. Beryllium its Metallurgy and Properties. University of California Press. 1965: 239.
- ↑ Majumdar, D. K. Irrigation Water Management: Principles and Practice , 2004 ISBN 978-81-203-1729-1 p. 108
- ↑ Chandrasekharan, H. and Gupta, Navindu Fundamentals of Nuclear Science – Application in Agriculture , 2006 ISBN 978-81-7211-200-4 pp. 202 ff
- ↑ Dixon, W.R.; Bielesch, Alice; Geiger, K. W. Neutron Spectrum of an Actinium–Beryllium Source. Can. J. Phys./Rev. Can. Phys. 1957, 35 (6): 699–702. Bibcode:1957CaJPh..35..699D. doi:10.1139/p57-075.
- ↑ Improved in Vivo Stability of Actinium-225 Macrocyclic Complexes.
- ↑ McDevitt, Michael R.; Ma, Dangshe; Lai, Lawrence T.; et al. Tumor Therapy with Targeted Atomic Nanogenerators (PDF). Science. 2001, 294 (5546): 1537–1540. Bibcode:2001Sci...294.1537M. PMID 11711678. doi:10.1126/science.1064126.
- ↑ Borchardt, Paul E.; et al. Targeted Actinium-225 in Vivo Generators for Therapy of Ovarian Cancer (PDF). Cancer Research. 2003, 63 (16): 5084–5090 [2013-12-14]. PMID 12941838.
- ↑ Ballangrud, A. M.; et al. Alpha-particle emitting atomic generator (Actinium-225)-labeled trastuzumab (herceptin) targeting of breast cancer spheroids: efficacy versus HER2/neu expression. Clinical cancer research : an official journal of the American Association for Cancer Research. 2004, 10 (13): 4489–97. PMID 15240541. doi:10.1158/1078-0432.CCR-03-0800.
- ↑ Nozaki, Yoshiyuki. Excess 227Ac in deep ocean water. Nature. 1984, 310 (5977): 486. Bibcode:1984Natur.310..486N. doi:10.1038/310486a0.
- ↑ Geibert, W.; Rutgers Van Der Loeff, M.M.; Hanfland, C.; Dauelsberg, H.-J. Actinium-227 as a deep-sea tracer: sources, distribution and applications. Earth and Planetary Science Letters. 2002, 198: 147. Bibcode:2002E&PSL.198..147G. doi:10.1016/S0012-821X(02)00512-5.
- ↑ Langham, W.; Storer, J. Toxicology of Actinium Equilibrium Mixture. Los Alamos Scientific Lab.: Technical Report. 1952. doi:10.2172/4406766.
外部链接
- 元素锕在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 锕(英文)
- 元素锕在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素锕在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 锕(英文)
- NLM Hazardous Substances Databank – Actinium, Radioactive
- Actinium in Haire, Richard G. Morss; Edelstein, Norman M.; Fuger, Jean , 编. The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer. 2006. ISBN 1-4020-3555-1.

