
电子排布(英语:electron configuration),或称电子排序、电子构型,指电子在原子、分子或其他物理结构中的原子轨道或分子轨道上的排序及排列形态[1]例如,氖(Ne)原子的电子排布是 1s2 2s2 2p6, 使用下面说明的电子排布。
正如其他基本粒子,电子遵从量子物理学,而不是一般的经典物理学;电子也因此有波粒二象性。而且,根据量子物理学中的《哥本哈根诠释》,任一特定电子的确实位置是不会知道的(轨道及轨迹放到一旁不计),直至侦测活动进行使电子被侦测到。在空间中,该测量将会检测的电子在某一特定点的概率,和在这一点上的波函数的绝对值的平方成正比。
电子能够由发射或吸收一个量子的能量从一个能级跃迁到另一个能级,其形式是一个光子。由于泡利不相容原理,没有两个以上的电子可以存在于某个原子轨道(轨道不等于电子层);因此,一个电子只可跨越到另有空缺位置的轨道。
知道不同的原子的电子构型有助了解元素周期表中的元素的结构。这个概念也有用于描述约束原子的多个化学键。在块体材料的研究中这一理念可以说明激光器和半导体的奇特性能。
原子轨道的种类
作为薛定谔方程的解,原子轨道的种类取决于主量子数(n)、角量子数(l)和磁量子数(ml)。其中,主量子数就相当于电子层,角量子数相当于亚层,而磁量子数决定了原子轨道的伸展方向。另外,每个原子轨道里都可以填充两个电子,所以对于电子,需要再加一个自旋磁量子数(ms),一共四个量子数。
n 可以取任意正整数。在 n 取一定值时,l 可以取小于 n 的自然数,ml 可以取 -l 到 +l。不论什么轨道,ms 都只能取±1/2,两个电子自旋相反。因此,s轨道(l=0)上只能填充2个电子,p轨道(l=1)上能填充6个,一个轨道填充的电子数为4l+2。
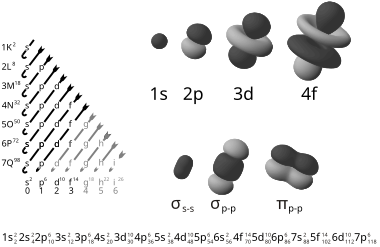
具有角量子数0、1、2、3的轨道分别叫做s轨道、p轨道、d轨道、f轨道。之后的轨道名称,按字母顺序排列,如角量子数l=4时叫g轨道。
排布的规则
电子的排布遵循以下规则:
- 构造原理:整个体系的能量越低越好。一般来说,新填入的电子都是填在能量最低的空轨道上的。
- 洪德规则:电子尽可能的占据不同轨道,自旋方向相同。
- 泡利不相容原理:在同一体系中,没有两个电子的四个量子数是完全相同的。
- 能级交错:电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。
| 1s | ||||
| 2s | 2p | |||
| 3s | 3p | |||
| 4s | 3d | 4p | ||
| 5s | 4d | 5p | ||
| 6s | 4f | 5d | 6p | |
| 7s | 5f | 6d | 7p | |
| 8s | 5g | 6f | 7d | 8p |
有些原子的排布不完全遵守上面的规则,如:
这是因为同一亚层中,全充满、半充满、全空的状态是最稳定的。这种方式的整体能量比3d44s2要低,因为所有亚层均处于稳定状态。
- 排布示例
以铬为例:
- 铬原子核外有24个电子,可以填满1s至4s所有的轨道,还剩余4个填入3d轨道:
- 1s22s22p63s23p64s23d4
- 由于半充满更稳定,排布发生变化:
- 1s22s22p63s23p64s13d5
- 除了6个价电子之外,其余的电子一般不发生化学反应,于是简写为:
- [Ar]4s13d5
- 这里,具有氩的电子构型的那18个电子称为“原子实”。一般把主量子数小的写在前面:
- [Ar]3d54s1
电子构型对性质的影响
电子的排布情况,即“电子构型”,是元素性质的决定性因素。为了达到全充满、半充满、全空的稳定状态,不同的原子选择不同的方式。具有同样价电子构型的原子,理论上得或失电子的趋势是相同的,这就是同一族元素性质相近的原因;同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去。
元素周期表中的区块是根据价电子构型的显著区别划分的。不同区的元素性质差别同样显著:如s区元素只能形成简单的离子,而d区的过渡金属可以形成配位化合物。
参见
参考资料
- ↑ 国际纯化学和应用化学联合会."configuration (electronic)".《化学术语总目录》在线版.(英文)